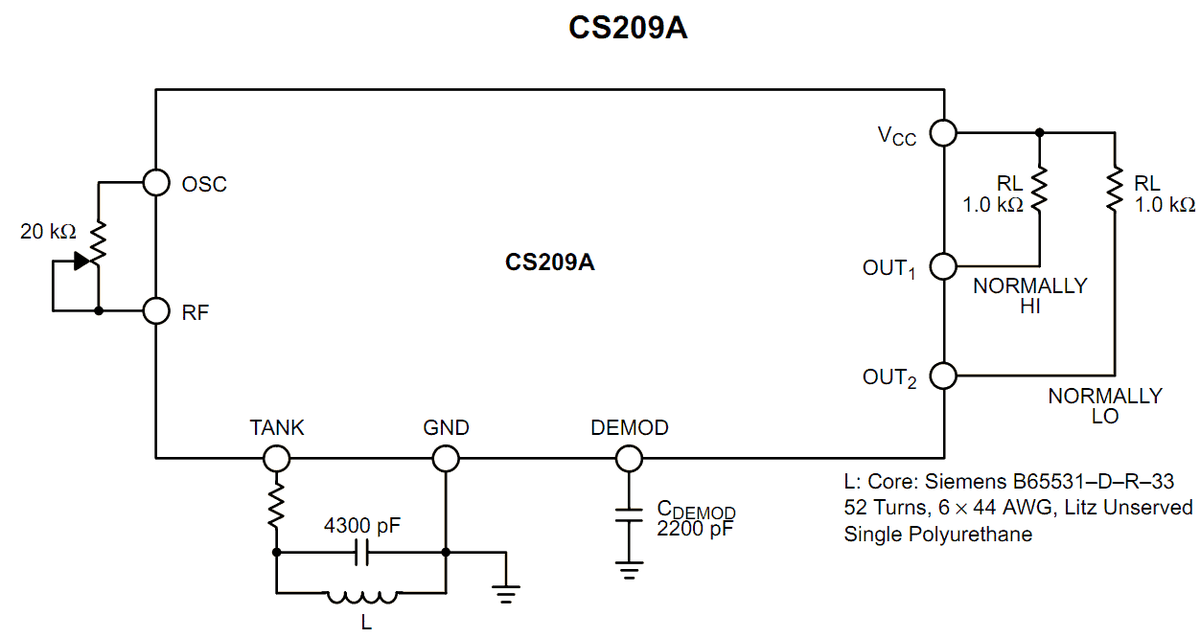
Die Anordnung der Moleküle in Festkörpern, Flüssigkeiten und Gase sind nicht gleich. In Festkörpern sind sie eng angeordnet, so dass sich die Elektronen innerhalb der Molekülatome in das Orbital der benachbarten Atome bewegen. In Gasen ist die Molekülanordnung nicht eng, während sie in Flüssigkeiten moderat ist. Daher decken die Elektronenorbitale teilweise ab, wenn sich die Atome gegenseitig nähern. Aufgrund der Kombination von Atomen in Festkörpern werden als Alternative zu einzelnen Energieniveaus die Niveaus von Energiebändern gebildet. Der Satz von Energieniveaus ist eng gepackt, was als Energieband bekannt ist.
Was ist Energieband?
Die Energiebanddefinition ist die Anzahl der Atome innerhalb ein Kristallstein kann näher beieinander sein, und eine Reihe von Elektronen interagieren miteinander. Die Energieniveaus von Elektronen in ihrer Hülle können aufgrund der Änderungen ihrer Energieniveaus verursacht werden. Das Hauptmerkmal von die Energie Band ist, dass die Energiezustände des Elektrons in der Elektronik in verschiedenen Bereichen stabil sind. Das Energieniveau eines Atoms ändert sich also in Leitungs- und Valenzbändern.
Energieband-Theorie
Nach der Bohr-Theorie enthält jede Hülle eines Atoms eine unterschiedliche Energiemenge auf unterschiedlichen Ebenen. Diese Theorie gibt hauptsächlich Details über die Kommunikation von Elektronen zwischen der Innenschale und der Außenschale. Gemäß der Theorie des Energiebandes werden die Energiebänder in drei Typen eingeteilt, die die folgenden umfassen.

Energieband-Theorie
- Valenzband
- Verbotene Energielücke
- Leitungsband
Volantband
Der Elektronenfluss innerhalb der Atome in festen Energieniveaus, jedoch ist die Energie des Elektrons in der inneren Hülle der äußeren Hülle der Elektronen überlegen. Die in der Außenhülle vorhandenen Elektronen werden als Valenzelektronen bezeichnet.
Diese Elektronen umfassen eine Folge von Energieniveaus, die ein Energieband bilden, das als Valenzband bezeichnet wird. Dieses Band enthält die maximal belegte Energie.
Leitungsband
Die Valenzelektronen sind bei Raumtemperatur lose an den Kern gebunden. Einige der Elektronen von Valenzelektronen verlassen das Band frei. Diese werden also freie Elektronen genannt, weil sie zu den benachbarten Atomen fließen.
Diese freien Elektronen leiten den Stromfluss innerhalb eines Leiters, der als Leitungselektronen bekannt ist. Das Band, das Elektronen enthält, wird als Leitungsband bezeichnet, und die belegte Energie davon ist geringer.
Verbotene Lücke
Die verbotene Lücke ist die Lücke zwischen dem Leitungsband und dem Valenzband. Diese Band ist ohne Energie verboten. Daher gibt es in diesem Band keinen Elektronenfluss. Der Elektronenfluss von der Valenz zur Leitung wird durch diesen Spalt geleitet.
Wenn diese Lücke größer ist, sind die Elektronen im Valenzband stark an den Kern gebunden. Gegenwärtig ist eine kleine äußere Kraft erforderlich, um die Elektronen aus diesem Band auszutreiben, was der verbotenen Energielücke entspricht. In der folgenden Abbildung sind die beiden Bänder sowie eine verbotene Lücke unten dargestellt. Basierend auf der Spaltgröße wird die Halbleiter , Leiter und Isolatoren werden gebildet.
Arten von Energiebändern
Die Energiebänder werden nämlich in drei Typen eingeteilt
- Isolatoren
- Halbleiter
- Dirigenten
Isolatoren
Die besten Beispiele für einen Isolator sind Holz und Glas. Diese Isolatoren erlauben das nicht Stromfluss durch sie fließen. Die Isolatoren haben eine extrem niedrige Leitfähigkeit und einen hohen spezifischen Widerstand. Im Isolator ist die Energielücke mit 7 eV extrem hoch. Das Material kann aufgrund des Elektronenflusses von den Bändern nicht funktionieren, da eine Valenz zur Leitung nicht durchführbar ist.

Energieband-in-Isolatoren
Zu den Hauptmerkmalen von Isolatoren gehört vor allem, dass die Energielücke wie verboten extrem groß ist. Bei einigen Arten von Isolatoren können sie bei steigender Temperatur eine gewisse Übertragung veranschaulichen.
Halbleiter
Die besten Beispiele für Halbleiter sind Silizium (Si) und Germanium (Ge), die am häufigsten verwendet werden. Die elektrischen Eigenschaften dieser Materialien liegen sowohl bei Halbleitern als auch bei Isolatoren. Die folgenden Bilder zeigen das Energiebanddiagramm des Halbleiters überall dort, wo das Leitungsband frei sein kann und das Valenzband vollständig gefüllt ist. Die verbotene Lücke zwischen diesen Bändern ist jedoch winzig und beträgt 1 eV. Die verbotene Lücke von Ge beträgt 0,72 eV und Si beträgt 1,1 eV. Daher benötigt Halbleiter wenig Leitfähigkeit.

Energieband-in-Halbleiter
Zu den Hauptmerkmalen von Halbleitern gehört vor allem, dass die Energielücke wie verboten extrem klein ist. Wenn die Temperatur des Halbleiters ansteigt, nimmt die Leitfähigkeit ab.
Dirigenten
Der Leiter ist eine Art Material, bei dem die verbotene Energielücke verschwindet, so wie das Valenzband und das Leitungsband extrem eng werden und sich teilweise bedecken. Die besten Beispiele für Leiter sind Gold, Aluminium, Kupfer und Gold. Die Verfügbarkeit der freien Elektronen bei Raumtemperatur ist enorm. Das Energiebanddiagramm des Leiters ist unten gezeigt.

Energieband-in-Leiter
Zu den Hauptmerkmalen von Leitern gehört vor allem, dass die Energielücke wie verboten nicht existiert. Die Energiebänder wie Volant und Leitung überlappen sich. Die Verfügbarkeit freier Elektronen für die Leitung ist ausreichend. Die Leitung nimmt zu, sobald die geringe Anzahl von Spannungen ansteigt.
Hier geht es also um einen Überblick über das Energieband . Aus den obigen Informationen können wir schließlich schließen, dass die Anordnung des Moleküls in Substanzen wie Feststoffen, Flüssigkeiten und Gasen unterschiedlich ist. In Gasen sind die Moleküle nicht nahe beieinander, in Festkörpern sind die Moleküle sehr eng angeordnet und in Flüssigkeiten sind die Moleküle mäßig angeordnet. Die Elektronen in den Atomen des Moleküls neigen also dazu, in die Orbitale benachbarter Atome zu fließen. Daher bedecken die Elektronenorbitale teilweise, während sich die Atome gemeinsam nähern. Aufgrund der Vermischung von Atomen in Festkörpern werden als Ersatz für nur Energieniveaus die Energiebänder gebildet. Diese sind dicht gepackt und werden als Energiebänder bezeichnet. Hier ist eine Frage an Sie, Energieband in Festkörpern?