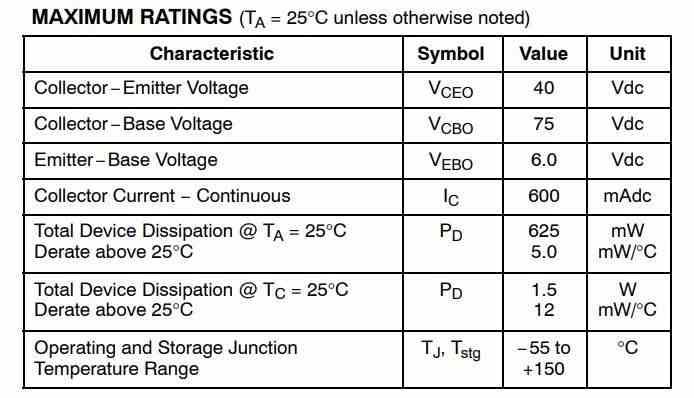
Eine Trockenzelle ist die einfachste Form der Stromerzeugungsquelle. Eine Anzahl von Zellen, die Zellen miteinander verbinden, bilden eine Batterie. Das Blei-Säure oder Nickel-Cadmium Batterie ist die erweiterte Version von Dry Cell. Diese Zelle wurde erstmals 1866 vom französischen Ingenieur Georges Leclanche erfunden. Seine Erfindung wurde nach seinem Namen als Leclanche-Batterie benannt. Aber zu dieser Zeit war es sehr schwer und konnte leicht zerbrochen werden. Eine Trockenzelle hat das gleiche Prinzip und ist die fortschrittliche Version der Leclanche-Batterie. Sie ist in verschiedenen Spannungen und Größen erhältlich. Die kommerzielle Form der Zink-Kohlenstoff-Zelle, die modifizierte Form der Leclanche-Batterie, wurde 1881 von Carl Gassner aus Mainz erfunden. Es wird in großen Mengen hergestellt und in vielen Anwendungen wie Spielzeug, Radios, Taschenrechnern usw. verwendet.
Was ist eine Trockenzelle?
Eine Trockenzelle ist ein Gerät, das aus chemischen Reaktionen Strom erzeugt. Wenn die beiden Elektroden der Zelle über einen geschlossenen Pfad verbunden sind, zwingt die Zelle die Elektronen, von einem Ende zum anderen zu fließen. Durch den Elektronenfluss fließt der Strom im geschlossenen Kreislauf.

Trockenzellschichten
Mit Hilfe chemischer Reaktionen fließen die Elektronen von einem Ende zum anderen. Wenn zwei oder mehr Zellen mit der richtigen Polarität verbunden sind, fließen aufgrund des hohen Potentials mehr Elektronen. Diese Kombination wird als Batterie bezeichnet. Ab einer Mindestspannung von 1,5 V bis 100 V kann eine Batterie verwendet werden, um einen Spannungsbereich zu erhalten. Sogar die Ausgangsgleichspannung der Batterie kann mit leistungselektronischen Wandlern wie z Hubschrauber Schaltungen.
Struktur der Zelle
Die Struktur der Zink-Kohlenstoff-Trockenzelle ist in der Abbildung dargestellt. Es besteht aus dem Anodenanschluss als Zink oder allgemein als Graphitstab. Der Kohlenstoff bildet den Kathodenanschluss. Es kann beobachtet werden, dass in älteren Versionen von Trockenzellen das Zink als Kathode und Graphit als Anodenanschluss verwendet wurde. Die Auswahl der Elemente basiert im Wesentlichen auf ihrer chemischen Konfiguration der äußersten Umlaufbahn der Elemente.

Trockenzellstruktur
Wenn es mehr Elektronen in der äußersten Umlaufbahn hat, kann es als Donor wirken und bildet somit die Kathode. In ähnlicher Weise kann die äußerste Umlaufbahn, wenn sie weniger Elektronen aufweist, leicht aufnehmen und somit die Anode bilden. Der dazwischen angeordnete Elektrolyt wirkt als Katalysator für die chemischen Reaktionen. Im Allgemeinen verwenden wir Ammoniumchloridgelee als Elektrolyt. In der gezeigten Figur ist der verwendete Elektrolyt eine Mischung aus Zink und Chlorid. Auch Natriumchlorid wird als Elektrolyt verwendet. Eine Mischung aus Mangandioxid und Kohlenstoff ist um den Anodenstab herum umgeben.
Die gesamte Konfiguration befindet sich in einem Metallrohr. Das Austrocknen des Gelees wird durch Verwendung eines Peches oben in der Zelle verhindert. Am Boden befindet sich eine Carbonscheibe. Der Zweck dieser Unterlegscheibe besteht darin, zu verhindern, dass der Zinkanodenstab mit dem Behälter in Kontakt kommt.
Dies wird auch als Abstandshalter bezeichnet, wie in der Abbildung gezeigt. Die Zinkdose ist zu Isolationszwecken auch von einer Papierisolierung umgeben. Für große Batterien werden auch andere Isoliermaterialien wie Glimmer usw. verwendet. Der positive Anschluss der Ell ist oben ausgebildet. Der negative Anschluss der Zelle wird an der Basis gebildet.
Arbeiten von Trockenzellen
Eine Trockenzelle arbeitet grundsätzlich an chemischen Reaktionen. Aufgrund der Reaktionen, die zwischen dem Elektrolyten und den Elektroden stattfinden, fließen die Elektronen von einer Elektrode zur anderen. Substanzen wie Säuren lösen sich in Wasser unter Bildung ionisierter Partikel. Es gibt zwei Arten von ionisierten Partikeln. Die positiven Ionen werden Kationen genannt und die negativen Ionen werden Anionen genannt. Die in Wasser gelösten Säuren werden Elektrolyte genannt.
In dem oben erwähnten Diagramm bildet sich das Zinkchlorid als Elektrolyt. In ähnlicher Weise bildet sich auch Ammoniumchloridgelee als Elektrolyt. Die in Elektrolyte eingetauchten Metallstäbe bilden Elektroden. Basierend auf den chemischen Eigenschaften der Metallstäbe haben wir eine positive Elektrode als Anode und eine negative Elektrode als Kathode.
Die Elektroden ziehen die entgegengesetzt geladenen Ionen an ihre Seite. Zum Beispiel zieht die Kathode die Anionen an und die Anode zieht die Kationen an. In diesem Prozess fließen die Elektronen von einer Richtung in die andere, daher erhalten wir einen Ladungsfluss. Das nennt man Strom .
Chemische Reaktionen
Die in der Zelle stattfindenden Reaktionen sind unten gezeigt. Erstens ist die Oxidationsreaktion.

Dabei wird die Zinkkathode zu positiv geladenen Zinkionen oxidiert, wobei zwei Ionen freigesetzt werden. Diese Elektronen werden von der Anode gesammelt. Dann kommt die Reduktionsreaktion.

Die Reduktionsreaktion an der Anode ist oben gezeigt. Diese Reaktion erzeugt einen elektrischen Strom. Es setzt Oxidionen mit Magnesiumoxid frei. Diese Reaktion entsteht, wenn Magnesium mit dem Elektrolyten kombiniert wird.


Die anderen beiden Reaktionen stellen eine Säure-Base-Reaktion und eine Fällungsreaktion dar, die in der Trockenzelle stattfinden. Bei der Säure-Base-Reaktion wird NH mit OH kombiniert, um NH3 zusammen mit Wasser zu erzeugen. Die Ergebnisse sind NH3 und Wasserbasis.
Unterschied zwischen einer Trockenzelle und einer Nasszelle
Der Hauptunterschied zwischen der Trockenzelle und der Nasszelle ist die Form des Elektrolyten. Wie zuvor diskutiert, ist in einer Trockenzelle der Elektrolyt wie Ammoniumchlorid von Natur aus trocken. Solche Trockenzellen sind häufiger und werden in Spielzeug, Radios usw. verwendet. In einer Nasszelle befindet sich der Elektrolyt jedoch im flüssigen Zustand.
Es werden flüssige Elektrolyte wie Schwefelsäure verwendet, die eine gefährliche ätzende Flüssigkeit ist. Aufgrund der Natur solcher Flüssigkeiten ist die feuchte Zelle explosiver und muss mit Vorsicht behandelt werden. Der beste Vorteil solcher Nasszellen besteht darin, dass sie leicht aufgeladen und für zahlreiche Anwendungen verwendet werden können. Solche Batterien werden häufig in der Luftfahrt, in Versorgungsunternehmen, in Energiespeichern und in Handytürmen verwendet.
Trockenzellenfunktionen
Die Trockenzellenfunktion basiert auf den chemischen Reaktionen zwischen der Elektrode und den Elektrolyten. Wenn die Elektroden in den Elektrolyten platziert werden, zieht sie die entgegengesetzt geladenen Ionen zu sich hin an. Dies bewirkt den Ladungsfluss und somit wird Strom erzeugt.
Vorteile
Das Vorteile der Trockenzelle das Folgende einschließen.
- Die Trockenzelle hat zahlreiche Vorteile wie z
- Es ist klein.
- Es kann in einer Vielzahl von Spannungspegeln kommen.
- Es ist praktisch und hat zahlreiche Anwendungen.
- Es ist die einzige Gleichspannungsquelle.
- Es kann zusammen mit leistungselektronischen Schaltungen zur Regelung der Ausgangsspannung verwendet werden
- Es ist wiederaufladbar.
Nachteile
Das Nachteile der Trockenzelle das Folgende einschließen.
- Es muss mit Vorsicht behandelt werden
- Es ist explosiv
- Große Batterien sind sehr schwer
Anwendungen
Das Anwendungen der Trockenzelle das Folgende einschließen.
- Spielzeuge
- Luftfahrt
- Handys
- Radio
- Taschenrechner
- Uhren
- Hörgeräte
Daher haben wir die Funktionsweise, Klassifizierung und Anwendung der trockene Zellen . Ein interessanter Punkt ist, dass die Batterie nur funktioniert, wenn die Elektroden physisch miteinander in Kontakt stehen. Zwischen den beiden Elektroden muss ein leitendes Medium vorhanden sein. Die Frage ist, ob Wasser als leitendes Medium zwischen den Elektroden der Trockenzelle verwendet werden kann. Was passiert in diesem Fall, wenn diese Zelle in Wasser getaucht wird?